
Il dolore nociplastico. Da patologia sine materia a disfunzione del sistema nervoso
Marina de Tommaso
UOC di Neurofisiopatologia, Università di Bari Aldo Moro, AOU Policlinico, Bari
Il dolore come sintomo ed esperienza soggettiva
L’Associazione Internazionale per lo studio del dolore (IASP) ha definito il dolore nociplastico come un dolore causato da alterata nocicezione, a fronte di assenza di evidente danno tissutale connesso ad attivazione dei nocicettori periferici, ovvero malattia o lesione del sistema somatosensoriale (Kosek et al., 2016).
È stata così individuata una terza tipologia di dolore, accanto al dolore con evidenza di infiammazione, ovvero il dolore nocicettivo, e a quello con evidenza di lesione o malattia del sistema somatosensoriale, ovvero il dolore neuropatico.
Queste due ultime tipologie, accanto al sintomo del dolore, necessitano di segni obiettivi per la diagnosi, nel primo caso dell’evidenza dell’infiammazione con il conseguente danno tissutale, esempio per tutti l’artrite, nel secondo caso della patologia a carico del sistema somatosensoriale, per esempio la sclerosi multipla e la neuropatia diabetica. Nel dolore neuropatico, il neurologo riconosce i segni obiettivi neurologici, confortati dai reperti di neuroimmagine e neurofisiologici.
Precedentemente alla definizione di dolore nociplastico, la presenza del sintomo necessitava del riconoscimento di una patologia neurologica, reumatologica o generalmente internistica sottostante, con i relativi segni obiettivi. Tutto quanto non corroborato da tali evidenze veniva ascritto alla cosiddetta categoria del “dolore sine materia”, in forse tra simulazione e somatizzazione (Garcia Larrea et al., 2002).
Le neuroscienze cliniche però si evolvono nella direzione di dare senso al sintomo, sia motorio che ancora più sensitivo. La presenza del sintomo implica comunque una disfunzione del sistema nervoso centrale, ampiamente supportata dal complesso funzionamento dei sistemi di controllo del dolore, condizionati dal contesto e dalle variabili cognitive e psicopatologiche (Tracey e Manthy, 2007).
Aree corticali coinvolte nella cognizione, nell’emozione, nel comportamento sociale, contestuale e relazionale si attivano per conferire alla sensazione dolorosa la connotazione soggettiva, che perde la correlazione lineare con la causa primaria del dolore stesso (Figura 1).
Figura 1 Meccanismi corticali di controllo del dolore
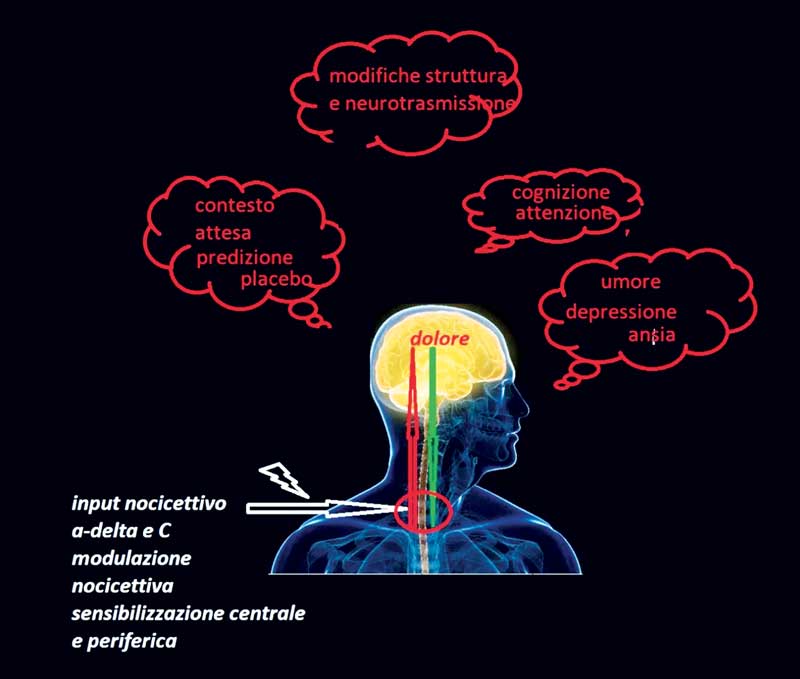
Fonte: liberamente adattato da Tracey I, Mantyh PW, 2017
La sensibilizzazione centrale e le sindromi associate
Il fenomeno della sensibilizzazione centrale, intesa come alterato funzionamento dei sistemi di controllo inibitorio del dolore, è ora riconosciuto meccanismo comune a numerose patologie di incredibile impatto in termini di disabilità e costi sociali e sanitari (Arendt-Nielsen et al., 2018).
Il dolore pelvico e lombare cronico, la dismenorrea primaria, la cefalea tensiva cronica, la forma cronica dell’emicrania, la sindrome dell’intestino irritabile sono patologie senza compromissione evidente degli organi primariamente coinvolti, ma caratterizzate da una dismodulazione delle afferenze nocicettive da essi prodotte.
Diversi specialisti sono coinvolti nella gestione di tali patologie, dall’ortopedico, al gastroenterologo, al ginecologo, sebbene la base comune di esse risieda in un meccanismo puramente neurogeno, riconosciuto dagli specialisti neurologi alla base ad esempio della fisiopatologia delle cefalee primarie (de Tommaso e Sciruicchio, 2016) .
Dalla diagnosi alla patogenesi della fibromialgia: dal reumatologo al neurologo
La fibromialgia è forse la patologia più frequente e invalidante nell’ambito di quelle sopracitate, che peraltro spesso sono ad essa associate. Gli specialisti reumatologi sono stati tradizionalmente i referenti di tale patologia, essendo da sempre, più dei neurologi, esperti di condizioni di dolore cronico, per lo più di tipo infiammatorio. Ad essi il merito di aver sempre dedicato attenzione e conferito dignità a tale patologia, spesso negletta da altri specialisti, mediante classificazioni in grado di riconoscerla.
Nel 1990 il Collegio dei reumatologi americani definiva per la prima volta i criteri diagnostici della fibromialgia, riconoscendola quindi come patologia, sulla scorta dei sintomi soggettivi presentati (Wolfe et al., 1990). Tali criteri si basavano essenzialmente sul vissuto di dolore diffuso a tutto il corpo, sintomi associati come fatica e disturbi del sonno, e sensazione dolorosa nei cosiddetti punti trigger, siti muscolari di particolare sensibilità alla pressione.
La positività di un numero ritenuto congruo di tender points definiva la diagnosi, in parte basata su un fenomeno sostanzialmente allodinico, dato che lo stimolo meccanico evoca dolore solo in presenza del fenomeno di sensibilizzazione centrale. I reumatologi, nel riconoscere il fenomeno della sensibilizzazione centrale alla base del dolore fibromialgico, ammettevano l’assenza di cause infiammatorie di loro stretta pertinenza, ascrivendo quindi l’origine della fibromialgia a cause per lo più neurogene. Mentre la comunità neurologica focalizzava gli interessi di ricerca su altre categorie di dolore, come la cefalea e il dolore neuropatico, i reumatologi usavano gli strumenti delle neuroscienze cliniche, per spiegare il complesso fenomeno della dismodulazione centrale nei pazienti con fibromialgia. Gli studi di Risonanza Magnetica Funzionale, mettevano in luce una iperattivazione delle aree cerebrali deputate al controllo del dolore, anche in relazione a stimoli di bassa intensità (de Tommaso et al., 2022). Nel frattempo, i criteri diagnostici si evolvevano in modo da conferire massima rilevanza alla diffusione del dolore e ai sintomi associati, in particolare disturbi del sonno, fatica e turbe cognitive, oltre ad un ulteriore corredo sintomatologico, composto da sintomi gastrointestinali, psichiatrici-in particolare ansia e depressione- cefalea, fenomeno di Reynaud, ipertermia, secchezza delle mucose, turbe respiratorie (Wolfe et al., 2010).
L’esclusione dei tender points dai criteri diagnostici della fibromialgia veniva al più giustificata dalla loro scarsa rappresentazione anche in pazienti con quadro conclamato di dolori diffusi e condizioni associate, a riprova del fatto che il fenomeno di sensibilizzazione centrale può essere poco evidente a livello muscolare, ma manifestarsi in sintomi complessi con coinvolgimento multiorgano. La definizione diagnostica più recente messa a punto dai reumatologi, e assunta anche da comunità scientifiche neurologiche, come appunto quella italiana (De Vigili et al., 2023), ha semplificato i criteri del 2010, e ridotto il numero dei sintomi associati, focalizzandosi sui disturbi a livello intestinale, sulla comorbidità con cefalea e la presenza di depressione, oltre alla condizione di fatica, disturbi cognitivi e del sonno (Wolfe et al., 2016).
La novità di questo ulteriore aggiornamento dei criteri diagnostici è nella possibilità che la fibromialgia coesista con il dolore nocicettivo o neuropatico, a conferma che il meccanismo di sensibilizzazione centrale può rappresentare una complicanza che altera il quadro della malattia di base e configura una seconda malattia, e non una sindrome, associata alla prima condizione, riconoscibile e spesso anche più invalidante.
La frequente comorbilità con le cefalee primarie (de Tommaso, 2015) e la sempre crescente attenzione verso la base neurogena del dolore fibromialgico e il suo potenziale trattamento hanno attratto l’attenzione dei neurologi clinici, con ulteriore approfondimento delle cause di questa complessa patologia (de Tommaso et al., 2022). Gli studi neurofisiologici hanno confermato il difetto di modulazione centrale del dolore, espresso come ridotta abitudine a stimoli multimodali e in particolare dolorosi, analogamente ad altre condizioni spesso associate alla fibromialgia, come l’emicrania (de Tommaso et al., 2011).
Sistema nervoso centrale e periferico: nasce prima l’uovo o la gallina?
Con il crescente interesse dei neurologi verso questa patologia, emergeva una problematica inaspettata, cioè la coesistenza di una neuropatia periferica, a precipuo coinvolgimento delle fibre del dolore, cioè le cosiddette “piccole fibre” (Üçeyler et al., 2013).
Certamente la comunità clinica ha riconosciuto che tale patologia periferica impronta poco il quadro clinico, non avendo la fibromialgia alcun aspetto sindromico in comune con la classica neuropatia delle piccole fibre. Questa caratterizza pazienti con diabete, sindromi paraneoplastiche e disimmuni e si caratterizza per la sensazione di mani e piedi dolenti e brucianti, spesso in assenza dei sintomi associati che contraddistinguono la fibromialgia (Leone et al., 2023).
Il riconoscimento mediante biopsia di cute, esami neurofisiologici specifici per il sistema nocicettivo e per il sistema vegetativo di tale patologia periferica ha incentivato l’interesse dei neurologi e condotto a numerose ipotesi patogenetiche, che possano accomunare il disturbo neurogeno centrale e periferico in una mutua connessione causale (Aster et al, 2022).
La prima ipotesi patogenetica riguarda un rapporto di causa effetto tra patologia delle piccole fibre, incremento dell’afferenza nocicettiva da sensibilizzazione periferica e iperattivazione corticale in soggetti predisposti. In altri termini, in soggetti predisposti al fenomeno della alterata modulazione centrale del dolore, una neuropatia periferica dolorosa ancorché di lieve entità, può essere “letta” a livello centrale in modo paradosso (Brietzke et al, 2019).
Resta comunque il quesito relativo alle cause di tale patologia delle piccole fibre come potenziale innesco del successivo fenomeno di sensibilizzazione centrale.
Una predisposizione genetica potrebbe giustificare entrambe le condizioni di sensibilizzazione periferica e centrale, con anomalie dell’eccitabilità neuronale connesse ai canali ionici, come i canali TRPA1 (Marchi et al., 2023). Questi risultati potrebbero aprire uno scenario su potenziali terapie target, cioè trattamenti connessi alla specifica anomalia.
Fenomeni autoimmunitari potrebbero parimenti giustificare il danno delle piccole fibre, con conseguente iperattivazione centrale su predisposizione individuale. Questa ipotesi è attraente, soprattutto in vista di un potenziale effetto di trattamenti miranti a ridurre la disimmunità, ma purtroppo esclusivamente sostenuta da evidenze su modelli animali (Goebel et al, 2021).
Un’ipotesi alternativa e attraente è stata parimenti suggerita da studi su animali. L’iperattivazione corticale di aree deputate alla percezione ed elaborazione del dolore, come l’insula, sarebbe in grado di determinare un effetto compensatorio a livello periferico, con un progressivo depauperamento dei terminali nocicettivi (Harte et al, 2017). Questa ipotesi suggerirebbe quindi un rimodellamento periferico delle afferenze nocicettive anche in patologie a prevalente genesi centrale, come la malattia di Parkinson e altre patologie degenerative del SNC (Nolano et al., 2017).
La stessa riduzione del movimento, peculiare dei pazienti con dolore cronico e soprattutto con fibromialgia (Gentile et al., 2020), può condurre ad un progressivo riadattamento delle afferenze somatosensoriali, incluse quelle dolorose, e ad una alterazione dei meccanismi di interazione sensorimotoria.
Come trattare il dolore nociplastico e la fibromialgia?
La complessità sintomatologica della fibromialgia non consente a tutt’oggi un trattamento farmacologico di provata efficacia. I farmaci che modulano la trasmissione del dolore, utilizzati nel dolore neuropatico, quali pregabalin/gabapentin, duloxetina e amitriptilina hanno efficacia limitata e sono gravati da numerosi effetti collaterali, peraltro molto avvertiti dai pazienti data l’accentuata attenzione verso i sintomi somatici e viscerali. (Mac Farlane et al., 2017). La terapia basata su immunoglobuline non trova ovviamente studi che ne dimostrino l’evidenza di efficacia.
Il trattamento delle condizioni associate come l’emicrania, a tutt’oggi possibile per le nuove terapia target, può favorire una riduzione della disabilità (Tepper, 2023).
L’approccio non farmacologico rimane l’opzione più accreditata (Kundakci et al., 2022), ma comporta una globale presa in carico del paziente e un apporto multidisciplinare, spesso complesso nell’ambito della corrente organizzazione dei servizi sanitari.
L’azione mirata sul sistema cognitivo ed emozionale e la corretta manipolazione del contesto possono costituire strumenti potentissimi di rimodellamento delle aree corticali disfunzionali (Figura 1).
Tecniche di controllo dello stress e in generale l’apporto psicoterapico cognitivo-comportamentale portano alla necessaria consapevolezza della patologia e ai metodi di potenziale miglioramento.
La ripresa graduale dell’esercizio fisico, con programmi adattati alla condizione individuale, riattivano l’interazione sensorimotoria, determinando possibili effetti benefici sulla innervazione periferica e sul network motorio corticale in grado di inibire le aree coinvolte nella modulazione del dolore (Gentile et al., 2022).
Restituire la dignità al sintomo significa riconoscerne il potenziale effetto disabilitante, cercarne le cause e credere nella possibilità del rimedio e della guarigione.
Bibliografia
Kosek E, Cohen M, Baron R, Gebhart GF, Mico JA, Rice AS, Rief W, Sluka AK. Do we need a third mechanistic descriptor for chronic pain states? Pain 2016; 157: 1382–6.
Garcia-Larrea L, Convers P, Magnin M, André-Obadia N, Peyron R, Laurent B, Mauguière F. Laser-evoked potential abnormalities in central pain patients: the influence of spontaneous and provoked pain. Brain. 2002 Dec;125(Pt 12): 2766-81. doi: 10.1093/brain/awf275. PMID: 12429603.
Tracey I, Mantyh PW. The cerebral signature for pain perception and its modulation. Neuron. 2007 Aug 2; 55(3): 377-91. doi: 10.1016/j.neuron.2007.07.012. PMID: 17678852.
Arendt-Nielsen L, Morlion B, Perrot S, Dahan A, Dickenson A, Kress HG, Wells C, Bouhassira D, Drewes AM. Assessment and manifestation of central sensitisation across different chronic pain conditions. Eur J Pain. 2018 Feb; 22(2): 216-241. doi: 10.1002/ejp.1140. Epub 2017 Nov 5. PMID: 29105941.
de Tommaso M, Sciruicchio V. Migraine and Central Sensitization: Clinical Features, Main Comorbidities and Therapeutic Perspectives. Curr Rheumatol Rev. 2016; 12(2): 113-26. doi: 10.2174/1573397112666151231110813. PMID: 26717950.
Wolfe F, Smythe HA, Yunus MB, Bennett RM, Bombardier C, Goldenberg DL, Tugwell P, Campbell SM, Abeles M, Clark P et al. The American College of Rheumatology 1990 Criteria for the Classification of Fibromyalgia Report of the Multicenter Criteria Committee. Arthritis Rheum 1990; 33(2):160–72. https:// doi.org/ 10. 1002/ art. 17803 30203.
de Tommaso M, Vecchio E, Nolano M. The puzzle of fibromyalgia between central sensitization syndrome and small fiber neuropathy: a narrative review on neurophysiological and morphological evidence. Neurol Sci. 2022 Mar; 43(3): 1667-1684. doi: 10.1007/s10072-021-05806-x. Epub 2022 Jan 14. PMID: 35028777.
Wolfe F, Clauw DJ, Fitzcharles MA, Goldenberg DL, Katz RS, Mease P, Russell AS, Russell IJ, Winfield JB, Yunus MB. The American College of Rheumatology preliminary diagnostic criteria for fibromyalgia and measurement of symptom severity. Arthritis Care Res 2010; 62(5): 600–610. https:// doi. org/ 10.1002/ acr. 20140
de Tommaso M. Migraine and fibromyalgia. J Headache Pain. 2015 Dec; 16(Suppl 1): A45. doi: 10.1186/1129-2377-16-S1-A45. PMID: 28132343; PMCID: PMC4759113.
de Tommaso M, Federici A, Santostasi R, Calabrese R, Vecchio E, Lapadula G, Iannone F, Lamberti P, Livrea P. Laser-evoked potentials habituation in fibromyalgia. J Pain. 2011 Jan; 12(1): 116-24. doi: 10.1016/j.jpain.2010.06.004. Epub 2010 Aug 4. PMID: 20685171.
Üçeyler N, Zeller D, Kahn AK, Kewenig S, Kittel-Schneider S, Schmid A, Casanova-Molla J, Reiners K, Sommer C. Small fibre pathology in patients with fibromyalgia syndrome. Brain. 2013 Jun;136(Pt 6):1857-67. doi: 10.1093/brain/awt053. Epub 2013 Mar 9. PMID: 23474848.
Leone C, Galosi E, Esposito N, Falco P, Fasolino A, Di Pietro G, Di Stefano G, Camerota F, Vollert J, Truini A. Small-fibre damage is associated with distinct sensory phenotypes in patients with fibromyalgia and small-fibre neuropathy. Eur J Pain. 2023 Jan; 27(1): 163-173. doi: 10.1002/ejp.2049. Epub 2022 Nov 12. PMID: 36314856.
Aster HC, Evdokimov D, Braun A, Üçeyler N, Kampf T, Pham M, Homola GA, Sommer C. CNS imaging characteristics in fibromyalgia patients with and without peripheral nerve involvement. Sci Rep. 2022 Apr 25; 12(1): 6707. doi: 10.1038/s41598-022-10489-1. PMID: 35469050; PMCID: PMC9038916.
Wolfe F, Clauw DJ, Fitzcharles MA, Goldenberg DL, Häuser W, Katz RL, Mease PJ, Russell AS, Russell IJ, Walitt B. 2016 Revisions to the 2010/2011 fibromyalgia diagnostic criteria. Semin Arthritis Rheum 2016; 46(3):319–329. https:// doi. org/ 10. 1016/j. semar thrit. 2016. 08. 012
Devigili G, Di Stefano G, Donadio V, Frattale I, Mantovani E, Nolano M, Occhipinti G, Provitera V, Quitadamo S, Tamburin S, Toscano A, Tozza S, Truini A, Valeriani M, de Tommaso M. Clinical criteria and diagnostic assessment of fibromyalgia: position statement of the Italian Society of Neurology-Neuropathic Pain Study Group. Neurol Sci. 2023 Jul;44(7):2561-2574. doi: 10.1007/s10072-023-06836-3. Epub 2023 May 24. PMID: 37222872; PMCID: PMC10257633.
Brietzke AP, Antunes LC, Carvalho F, Elkifury J, Gasparin A, Sanches PRS, da Silva Junior DP, Dussán-Sarria JA, Souza A, da Silva Torres IL, Fregni F, Md WC. Potency of descending pain modulatory system is linked with peripheral sensory dysfunction in fibromyalgia: An exploratory study. Medicine (Baltimore). 2019 Jan;98(3):e13477. doi: 10.1097/MD.0000000000013477. PMID: 30653087; PMCID: PMC6370006.
Marchi M, Salvi E, Andelic M, Mehmeti E, D’Amato I, Cazzato D, Chiappori F, Lombardi R, Cartelli D, Devigili G, Dalla Bella E, Gerrits M, Almomani R, Malik RA, Ślęczkowska M, Mazzeo A, Gentile L, Dib-Hajj S, Waxman SG, Faber CG, Vecchio E, de Tommaso M, Lauria G. TRPA1 rare variants in chronic neuropathic and nociplastic pain patients. Pain. 2023 Apr 19. doi: 10.1097/j.pain.0000000000002905. Epub ahead of print. PMID: 37079850.
Goebel A, Krock E, Gentry C, Israel MR, Jurczak A, Urbina CM, Sandor K, Vastani N, Maurer M, Cuhadar U, Sensi S, Nomura Y, Menezes J, Baharpoor A, Brieskorn L, Sandström A, Tour J, Kadetoff D, Haglund L, Kosek E, Bevan S, Svensson CI, Andersson DA. Passive transfer of fibromyalgia symptoms from patients to mice. J Clin Invest. 2021 Jul 1;131(13): e144201. doi: 10.1172/JCI144201. PMID: 34196305; PMCID: PMC8245181.
Harte SE, Clauw DJ, Hayes JM, Feldman EL, St Charles IC, Watson CJ. Reduced intraepidermal nerve fiber density after a sustained increase in insular glutamate: a proof-of-concept study examining the pathogenesis of small fiber pathology in fibromyalgia. Pain Rep. 2017 Apr 15;2(3):e590. doi: 10.1097/PR9.0000000000000590. PMID: 29392206; PMCID: PMC5741296.
Nolano M, Provitera V, Manganelli F, Iodice R, Stancanelli A, Caporaso G, Saltalamacchia A, Califano F, Lanzillo B, Picillo M, Barone P, Santoro L. Loss of cutaneous large and small fibers in naive and l-dopa-treated PD patients. Neurology. 2017 Aug 22;89(8):776-784. doi:10.1212/WNL.0000000000004274. Epub 2017 Jul 26. PMID: 28747449.
Gentile E, Brunetti A, Ricci K, Delussi M, Bevilacqua V, de Tommaso M. Mutual interaction between motor cortex activation and pain in fibromyalgia: EEG-fNIRS study. PLoS One. 2020 Jan 23;15(1):e0228158. doi: 10.1371/journal.pone.0228158. PMID: 31971993; PMCID: PMC6977766.
Macfarlane GJ, Kronisch C, Atzeni F, Häuser W, Choy EH, Amris K, Branco J, Dincer F, Leino-Arjas P, Longley K, McCarthy G, Makri S, Perrot S, Sarzi Puttini P, Taylor A, Jones GT. EULAR recommendations for management of fibromyalgia. Ann Rheum Dis. 2017 Dec;76(12):e54. doi: 10.1136/annrheumdis-2017-211587. Epub 2017 May 5. PMID: 28476880.
George N, Tepper SJ. Novel Migraine Treatments: A Review. J Oral Facial Pain Headache. 2023 Winter;37(1):25-32. doi: 10.11607/ofph.3163. PMID: 36917235.
Kundakci B, Hall M, Atzeni F, Branco J, Buskila D, Clauw D, Crofford LJ, Fitzcharles MA, Georgopoulos V, Gerwin RD, Kosek E, Macfarlane GJ, Neal C, Rudin NJ, Ryan S, da Silva JAP, Taylor AM, Turk DC, Whibley D, Doherty M, Zhang W, Abhishek A. International, multidisciplinary Delphi consensus recommendations on non-pharmacological interventions for fibromyalgia. Semin Arthritis Rheum. 2022 Dec; 57: 152101. doi:10.1016/j.semarthrit.2022.152101. Epub 2022 Sep 24. PMID: 36183478.
Gentile E, Brunetti A, Ricci K, Bevilacqua V, Craighero L, de Tommaso M. Movement observation activates motor cortex in fibromyalgia patients: a fNIRS study. Sci Rep. 2022 Mar 18; 12(1): 4707. doi: 10.1038/s41598-022-08578-2. PMID: 35304530; PMCID: PMC8933439.


